索氏梭菌毒力因子主要包括致死毒素 TcsL 和出血毒素 TcsH,这两种毒素均属于大梭菌毒素( Large Clostridial Toxin, LCT )家族,该家族其他成员还包括艰难梭菌产生的毒素 TcdA 和 TcdB,产气荚膜梭菌的毒素 TpeL 以及诺维氏梭菌的毒素 Tcnα 等。TcsH 是该毒素家族中唯一细胞受体尚未阐明的重要成员,这在很大程度上阻碍了我们对其作用机理和发病机制的研究。
西湖大学生命科学学院的陶亮课题组专注于细菌毒素对宿主细胞功能的影响和作用机制的研究,先后发现了毒素 TcdA, Tcnα, TcdB 等的多个宿主细胞受体,部分研究成果已发表在 Cell, Cell Research, Nature Microbiology 等期刊上。近日,陶亮课题组在该领域再次取得新的突破。
北京时间2022年7月26日,团队在 Nature Communications 上在线发表题为 “Paeniclostridium sordellii hemorrhagic toxin targets TMPRSS2 to induce colonic epithelial lesions” 的研究论文,首次揭示 TMPRSS2 是 TcsH 的肠上皮受体,填补了多年以来对出血毒素 TcsH 知之甚少的领域空白。
论文链接:
https://www.nature.com/articles/s41467-022-31994-x

由于可参考的关于 TcsH 的先前研究相对稀少,团队在初期也遇到了不小的困难。其中一个难点就是合适的与毒素互作的靶向细胞的选择。与其它 LCT 相比,TcsH 在很多常见细胞株上表现出来的毒性很弱。研究团队意识到筛选合适细胞系的重要性,于是测试了大量的不同组织来源的细胞系,多数人源细胞系对 TcsH 都不敏感,但研究中也发现了两株特定的细胞,人结肠癌细胞系 HT-29 和人结直肠癌细胞系 Caco-2,对 TcsH 高度敏感。基于这一发现,团队选取了 HT-29 细胞作为研究 TcsH 的模式细胞,并且为了提高成功率,选择两个不同来源的人源 sgRNA 文库在 HT-29 细胞上构建敲除文库。通过 TcsH 压力筛选,研究者们发现这两个独立的筛选系统同时富集了一系列共同的靶向基因,包括跨膜丝氨酸蛋白酶2(TMPRSS2 )及岩藻糖基化修饰相关基因 GMDS、SLC35C1、FUT4(图1)。通过构建基因突变和回补细胞,研究者们证明这些基因对 TcsH 的细胞侵入起了重要作用。
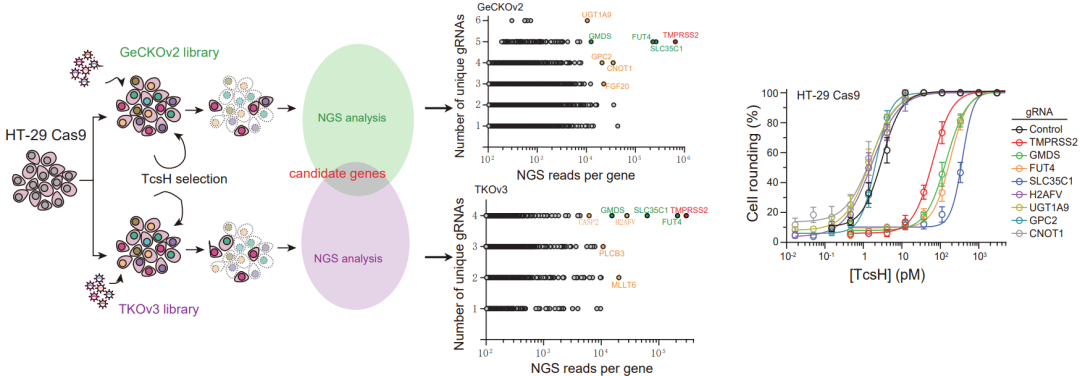
图1. CRISPR/Cas9介导的全基因组敲除筛选发现与TcsH作用相关的宿主基因
TMPRSS2 由于广泛参与了包括流感、SARS、MERS 等在内的多种病毒的细胞入侵而“臭名昭著”。TMPRSS2 参与病毒入侵的方式是通过其丝氨酸蛋白酶活性激活病毒的刺突蛋白,从而促进膜融合。有意思的是,TMPRSS2 的丝氨酸蛋白酶活性与其介导 TcsH 入侵完全无关(图2)。另一方面,TMPRSS2 可以特异性地与 TcsH 进行结合,亲和力高达0.13 nM。说明与“助攻”病毒感染的模式不同,TMPRSS2 是作为直接的蛋白受体协助毒素 TcsH 入侵靶向细胞的。
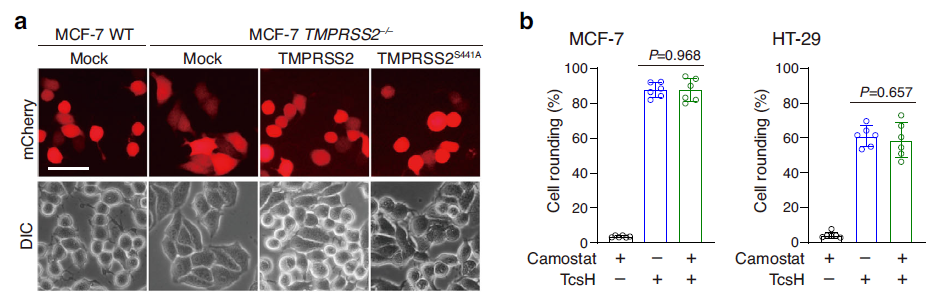
图2. TMPRSS2 的丝氨酸蛋白酶活性缺失不影响介导TcsH入侵
值得一提的是,TMPRSS2 仅在少部分细胞上有较高水平表达,且其在细胞中的表达量与该细胞对 TcsH 的敏感性吻合,这也解释了为何前期研究发现只有少数细胞株对 TcsH 是敏感的(图3)。
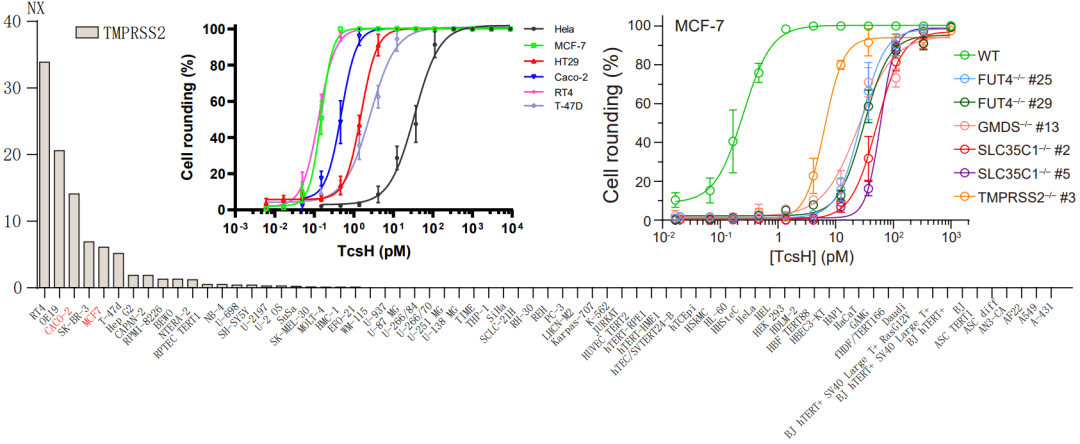
图3. TMPRSS2 高表达的细胞展现出对TcsH的高敏感性
另一方面,岩藻糖基化修饰广泛存在于许多细胞表面,研究发现其与 TcsH 在细胞表面的结合密切相关。通过进一步的生化和细胞学实验,包括构建敲除后补回实验、体外结合、竞争拮抗等,研究者们证明了 TMPRSS2 和岩藻糖化的作用是相互独立的,两者可竞争性地参与 TcsH 的细胞识别(图4)。
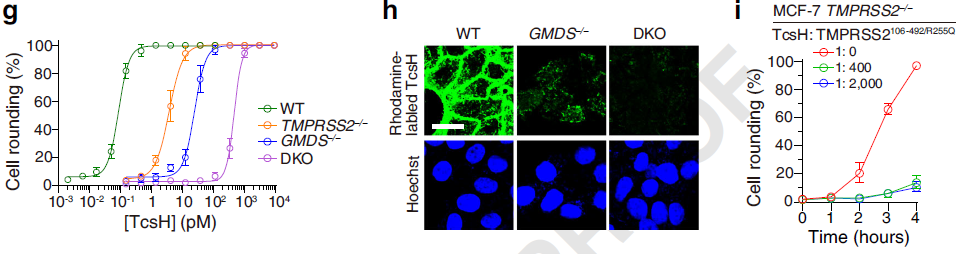
图4. TMPRSS2 和岩藻糖化多糖可作为TcsH两类相互独立的受体
最后,为进一步探究 TMPRSS2 在生理和病理学上的意义,研究者们利用了一种 Tmprss2 全敲除的小鼠模型。腹腔注射毒素后发现,野生型(Tmprss2+/+)和杂合型(Tmprss2+/‒)小鼠对TcsH的耐受性显著低于纯合型(Tmprss2‒/‒)小鼠。由于肠道是索氏梭菌定植的重要部位之一,且已知部分肠道上皮细胞有较高的 TMPRSS2 表达。后续研究者们利用野生型和 Tmprss2 敲除小鼠构建肠道结扎模型,结果显示 TcsH 处理后 Tmprss2 敲除小鼠结肠上皮损伤明显小于野生型小鼠(图5)。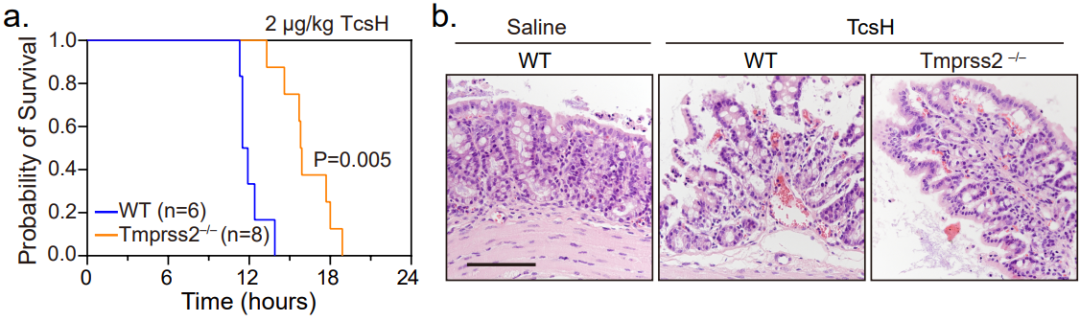
图5. 小鼠模型显示TMPRSS2 是TcsH重要的病理相关受体
西湖大学生命科学学院的陶亮研究员为本文通讯作者;陶亮课题组的博士研究生李星星和贺柳晴为共同第一作者;其他合作作者包括西湖大学的李颜颜博士,博士后罗建华,博士研究生郑洋铃、周瑶、李丹阳,及科研助理张媛媛和潘振瑞;此外还感谢西湖大学生科院的章永登研究员在荧光显微摄影方面提供的帮助。本课题受到国家自然科学基金、西湖实验室(生命科学和生物医学浙江省实验室)及西湖教育基金会的资助;项目实施还得到了西湖大学生物医学实验技术中心和实验动物中心的支持和帮助。
西湖大学微生物宿主交互实验室(实验室主页链接:https://tao.lab.westlake.edu.cn/)致力于研究微生物-宿主之间的相互作用方式和内在规律,尤其是从分子、生化、细胞、生信、结构等方面研究重要病原细菌及其致病因子对宿主的影响及作用机制。
西湖大学生命科学学院研究员陶亮近年来以通讯作者在 Cell、Cell Research、Nature Microbiology、Nature Communications、PLOS Pathogens 等学科主流期刊上发表多篇学术论文。实验室招收博士研究生,且有多个博士后、科研助理岗位,方向包括且不限于分子微生物学、生物信息学和微生物组学、生物化学、免疫学、细胞生物学等,诚邀各方青年才俊加入、携手共同成长!
联系方式:
taoliang@westlake.edu.cn





